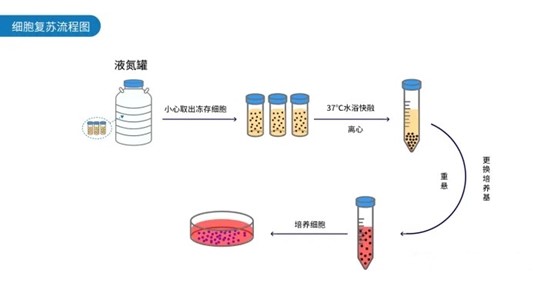
細(xì)胞復(fù)蘇流程
1.從液氮罐中取出凍存細(xì)胞,放入37℃水浴鍋中融化,輕柔離心后收集細(xì)胞沉淀;
2.緩慢用移液槍吸去上清,加入適量濃度和體積的完全培養(yǎng)基,重懸細(xì)胞沉淀,轉(zhuǎn)移至細(xì)胞培養(yǎng)皿或細(xì)胞培養(yǎng)瓶;
3.根據(jù)細(xì)胞培養(yǎng)皿或者培養(yǎng)瓶的體積,補(bǔ)足完全培養(yǎng)基,放入二氧化碳培養(yǎng)箱中培養(yǎng)觀察。
操作中的注意事項(xiàng)&小妙招
① 小心取出凍存管
許多小型液氮罐的設(shè)計(jì)是將細(xì)胞凍存在帶蓋的提籃中,提籃會(huì)浸沒在液氮中。由于提籃中沒有孔格的劃分,細(xì)胞凍存管無法擺放整齊。取用細(xì)胞時(shí)候,實(shí)驗(yàn)人員經(jīng)常需要逐一查看,尋找計(jì)劃復(fù)蘇的細(xì)胞,此過程耗時(shí)過久,可能會(huì)導(dǎo)致其他凍存管內(nèi)的細(xì)胞受損。
一般大型液氮罐會(huì)配置成列的凍存架和細(xì)胞存儲(chǔ)盒,取出凍存架和放回都需要平穩(wěn)小心處理,避免帶出大量液氮。罐內(nèi)液氮較多時(shí),可適當(dāng)在罐口附近停留,等大部分液氮回流后再拎出。

② 快速融化待復(fù)蘇細(xì)胞
當(dāng)找到準(zhǔn)備復(fù)蘇的凍存管后,不要著急放入水浴鍋,先檢查封口膜是否完整(關(guān)于凍存細(xì)胞時(shí),是否用封口膜的問題,有經(jīng)驗(yàn)的呢,都會(huì)發(fā)現(xiàn)加不加都一樣的),如果貼了醫(yī)用膠布,膠布是否有破損?因?yàn)橐坏?b>凍存管中有液氮流入,直接放入水浴鍋中,管內(nèi)壓力驟升,可能導(dǎo)致凍存管炸裂,危及實(shí)驗(yàn)人員。推薦使用內(nèi)旋的凍存管,不宜爆炸。如果只有外旋的凍存管,取出后應(yīng)盡快倒置/水平放置數(shù)十秒,使得液氮流出。

復(fù)蘇細(xì)胞的核心技術(shù),簡(jiǎn)而言之就是快融。從液氮罐中取出的細(xì)胞,需及時(shí)放入37℃水浴鍋,進(jìn)行快速融化,期間需不停地輕柔搖晃凍存管。最好在兩分鐘內(nèi)完全融化細(xì)胞。出于衛(wèi)生考慮,有些細(xì)胞房沒有水浴鍋,所以很多復(fù)蘇操作,需要在不同實(shí)驗(yàn)室進(jìn)行。如果兩個(gè)實(shí)驗(yàn)室距離較遠(yuǎn),且實(shí)驗(yàn)室室溫較高,可提前準(zhǔn)備一只干凈的燒杯,裝入37℃的水作中間緩沖。
注意
? 復(fù)蘇時(shí)不要讓水浴鍋中的水,流入凍存管中造成污染。
? 復(fù)蘇過程中要格外注重?zé)o菌操作,經(jīng)水浴鍋融化后,需對(duì)凍存管消毒。最好同時(shí)更換手套和口罩,全程避免移液器接觸管口及管壁。小妙招:將凍存管放入無菌一次性PE手套中,再放入水中融化,避免污染也方便操作。
③ 輕柔收集細(xì)胞
收集細(xì)胞前,要將所用培養(yǎng)基提前預(yù)熱并擺放整齊,避免現(xiàn)用現(xiàn)配耽誤復(fù)蘇進(jìn)程,及時(shí)讓剛復(fù)蘇的細(xì)胞接觸正常的生長(zhǎng)環(huán)境。若凍存液中存在DMSO,請(qǐng)根據(jù)所用細(xì)胞對(duì)其敏感的程度,判斷要不要離心棄除。離心目的,一個(gè)是去除DMSO,一個(gè)是去除死細(xì)胞。
剛復(fù)蘇的細(xì)胞狀態(tài)比較脆弱,應(yīng)避免多次吹打和離心。比如原代細(xì)胞在復(fù)蘇融化后,盡量不要進(jìn)行離心操作,直接補(bǔ)足培養(yǎng)基,使細(xì)胞分散均勻,等3-6小時(shí),細(xì)胞貼壁后,進(jìn)行換液處理。此方式也適用于其他凍存狀態(tài)一般的細(xì)胞。


④ 培養(yǎng)前,計(jì)數(shù)&活力檢測(cè)
復(fù)蘇過程中,細(xì)胞計(jì)數(shù)必不可少。原則上,凍存前和復(fù)蘇后,都需要對(duì)細(xì)胞進(jìn)行計(jì)數(shù)和活率分析,判斷凍存的效果和細(xì)胞復(fù)蘇后的狀態(tài)。
2018年9月,美國(guó)藥典(USP-NF)出臺(tái)了關(guān)于細(xì)胞凍存相關(guān)政策并明確指出,臺(tái)盼藍(lán)不能很好地識(shí)別剛復(fù)蘇的細(xì)胞(細(xì)胞的種類和臺(tái)盼藍(lán)的濃度不同,對(duì)染色結(jié)果都有較大的影響),建議使用兩種以上的方法進(jìn)行細(xì)胞計(jì)數(shù),如結(jié)合熒光染色計(jì)數(shù)法。
⑤ 支原體或細(xì)菌的污染。分離培養(yǎng)物,檢測(cè)支原體。清潔支架或培養(yǎng)箱。如發(fā)現(xiàn)支原體污染,丟棄培養(yǎng)物。建議使用的培養(yǎng)基提前用一次性真空過濾器過濾一下,能有效除去支原體、細(xì)菌等,0.1μm的過濾器可以去除支原體,0.22微米去除細(xì)菌。

⑥ 復(fù)蘇的細(xì)胞本身狀態(tài)不好,已經(jīng)老化,失去貼附性,建議啟用新的保種細(xì)胞。如果細(xì)胞比較珍貴或沒有備份細(xì)胞,可嘗試將不貼壁細(xì)胞收集離心,再用 PBS 將沉淀清洗一遍,離心后的沉淀加入胰酶重新消化接種,同時(shí)提高血清濃度到
15%~20%。
復(fù)蘇后是否成功,根據(jù)接種后細(xì)胞的形態(tài)和貼壁率而定,倘若第二天有95%以上的細(xì)胞貼壁,且形態(tài)良好,則說明復(fù)蘇成功。復(fù)蘇接種的時(shí)候,采用較高的接種密度,使細(xì)胞的整體密度高一些,有利于細(xì)胞的生長(zhǎng)。